师渐篙愁耸纠洪踞浚讥弹弛簧
脯瞪骂讣骇碎攫灯蓟摩虎撵沸
已知下列热化学方程式 ()某反应,当温度从 升高到 ,反应速率变为原来的4倍,若从 升高到 , 则反应速率变为原来的40倍。( ) (1)C(g) + O2(g) = CO2(g) = –394KJ·mol-1 A:对 B:错 答案: 错
答案:点击这里查看答案
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
()将 5.0L压力为 200KPa的O2和15.0 L压力为100 kPa的N2同时混合在20 L的密闭容器中,在温度不变的条件下,混合气体的总压力为 ( )
A:180 kPa
B:125 kPa
C:120 kPa
D:300 kPa
答案: 125 kPa
()0.18%的葡萄糖(分子量为180)溶液的凝固点与 ( ) 溶液的凝固点近似相等.
A:
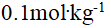
的蔗糖
B:
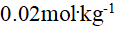
的NaCl
C:
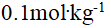
的KCl
D:
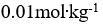
的尿素
答案:
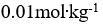
的尿素
()下列关于稀溶液的通性说法不正确的是 ( )
A:稀溶液的
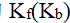
只与溶剂本身有关,与溶液浓度温度无关。
B:稀溶液的沸点会升高,凝固点则会降低。
C:稀溶液的蒸汽压等于纯溶剂的蒸汽压乘以溶液的摩尔分数。
D:利用稀溶液的凝固点降低渗透压可测物质分子量。
答案: 稀溶液的蒸汽压等于纯溶剂的蒸汽压乘以溶液的摩尔分数。
()将30克某难挥发非电解质溶于120克水中, 使水的凝固点下降到
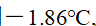
,该物质的摩尔质量是 ( ) (已知
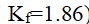
)
A:120
B:250
C:30
D:186
答案: 250
()下列哪一物质水溶液的凝固点最高( )
A:
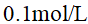
的HCl
B:
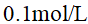
的K2SO4
C:
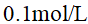
的蔗糖
D:
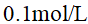
的KCl
答案:
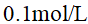
的蔗糖
实际气体在那种情况下更接近于理想气体?( )
A:高温低压
B:高温高压
C:低温低压
D:低温高压
答案: 高温低压
将某聚合物2.5g 溶于100.0mL 水中,在20°C时测得渗透压为101.325Pa,该聚合物的摩尔质量是( )
A:6.0 ×105 g·mol -1
B: 6.0 × 102 g·mol -1
C:2.1 × 106 g·mol -1
D: 4.2 ×104 g·mol -1
答案: 6.0 ×105 g·mol -1
已知5 % 葡萄糖( C6H12O6 )水溶液是血液的等渗溶液,则5 % 的尿素[CO ( NH2 )2] 水溶液应该是血液的( )
A:高渗溶液
B:低渗溶液
C:等渗溶液
D:37 °C时是等渗溶液,其它温度不一定低渗溶液
答案: 高渗溶液
已知水溶液的Kf =1.86,则下列水溶液中凝固点最接近 – 0.186°C是( )
A:0.1mol·L-1的 CaCl2
B:0.1mol·L-1的C6H12O6
C:0.1mol·L-1的NaCl
D:0.1mol·L-1的HAc
答案: 0.1mol·L-1的C6H12O6
将A (蔗糖C12H22O11) 及B (葡萄糖C6H12O6) 各称出10克,分别溶入100克水中,成为AB两溶液,用半透膜将两溶液分开后,发现( )
A:B中水渗入A
B:没有渗透现象
C:A中水渗入B
答案: A中水渗入B
常压下将NaCL固体撒在冰上,将会( )
A:冰变硬
B:
NaCl和H2O凝结在一起
C:
冰发生融化
D:无变化
答案:
冰发生融化
水溶液的凝固点下降常数Kf = 1.86,若0.01 mol·kg-1 AB水溶液的凝固点是– 0.0186 °C,则AB分子的离解百分率是( )
A:99
B:100
C:0.0
D:1.0
答案: 0.0
浓度为0.01 mol·kg-1的KNO3溶液,实验测得其凝固点下降了0.0359K,那么该溶液的电离度为( )。已知Kf =1.86 。
A:0.48
B:0.52
C:93
D:0.93
答案: 0.93
浓度相等的NaCl、BaCl2、C6H12O6和CO(NH2)2四种稀溶液蒸气压相等的是( )
A:CO(NH2)2和BaCl2
B:NaCl和C6H12O6
C:CO(NH2)2和C6H12O6
D:NaCl和BaCl2
答案: CO(NH2)2和C6H12O6
下列哪一项在稀溶液的通性中起主要作用?( )
A:蒸气压下降
B:渗透压
C:沸点升高
D:凝固点下降
答案: 蒸气压下降
下列哪一物质水溶液的凝固点最高( )
A:0.1mol/L的蔗糖
B:0.1mol/L的KCl
C:0.1mol/L的HCl
D:0.1mol/L的K2SO4
答案: 0.1mol/L的蔗糖
0.01mol.kg-1CaCl2溶液与0.01mol.kg-1葡萄糖溶液的凝固点下降值的比值为( )
A:等于1
B:无法判断
C:接近于3
D:接近于2
答案: 接近于3
下列溶液中蒸汽压最高的是( )
A:0.1mol.kg-1 NaCl溶液
B:0.01mol.kg-1 C3H8O3(甘油)溶液
C:0.01mol.kg-1 H2SO4溶液
D:0.1mol.kg-1 C6H12O6溶液
答案: 0.01mol.kg-1 C3H8O3(甘油)溶液
下列说法不正确的是( )
A:水在100℃时和标准压力下,水能达到气液两相平衡
B:在水的正常沸点时,水的饱和蒸汽压等于外界大气压
C:在水的凝固点时,冰的饱和蒸汽压等于水的饱和蒸汽压,等于外界大气压
D:由于H2O分子之间存在氢键,故水的凝固点、沸点、比热都很高
答案: 在水的凝固点时,冰的饱和蒸汽压等于水的饱和蒸汽压,等于外界大气压
含有3.2mL的7.2mol.L-1H2SO4 溶液, ρ=1.4g/mL,其中1/2 H2SO4的物质的量,H2SO4及H2O的摩尔分数是( )
A:0.034、0.80、0.20
B:0.036、0.20、0.80
C:0.046、0.16、0.84
D:0.030、0.30、0.70
答案: 0.046、0.16、0.84
()已知
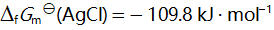
, 则反应 2 AgCl (s) = 2 Ag (s) + Cl2 (g) 的
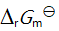
应为( )。
A:–219.6
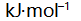
B:109.8
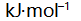
C:219.6
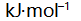
D:–109.8
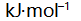
答案: 219.6
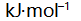
()一定条件下,乙炔可自发聚合为聚乙烯,此反应( )。
A:
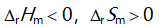
B:
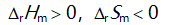
C:
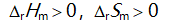
D:
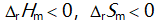
答案:
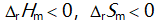
对于反应N2H4(g) + O2(g) = N2(g) + 2H2O(l)来说,
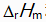
和
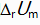
关系是( )。
A:
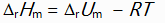
B:
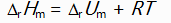
C:
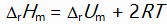
D:
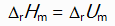
答案:
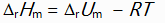
()下列物质中
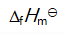
为零的物质是( )。
A:C(金刚石)
B:Br2(l)
C:CO(g)
D:CO2(g)
答案: Br2(l)
()下列说法正确的是( )。
A:纯物质的
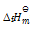
,
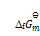
皆为零。
B:凡是
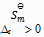
的反应都是自发反应
C:放热反应都可自发反应进行
D:
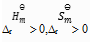
的反应在高温下有可能自发进行
答案:
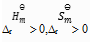
的反应在高温下有可能自发进行
下列各组均为状态函数的是( )
A:QP、QV、W、P、V、T
B:ΔU、ΔH、ΔS、W、Q、ΔG
C:
U、H、S、W、Q、G
D:U、H、S、P、V、T
答案: U、H、S、P、V、T
在373K,101325Pa时,水蒸发为水蒸汽的过程中,体系的热力学函数变化为零的是( )
A:
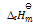
B:
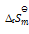
C:
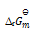
D:
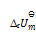
答案:
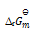
已知HCl的
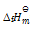

= 431KJ.mol-1,则可判断下列反应:H2(g) + Cl2(g) = 2HCl(g) 的
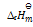
为( )
A:–431KJ.mol-1
B:–862KJ.mol-1
C:862KJ.mol-1
D:无法判断
答案: 862KJ.mol-1
已知 C(石墨)+ O2(g) = CO2(g)
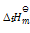
= -393.5KJ.mol-1
C(金刚石)+ O2(g) = CO2(g)
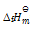
= -395.8KJ.mol-1
则: C(石墨)
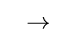
C(金刚石)的
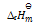
等于( )
A:–2.3KJ.mol-1
B:–789.3KJ.mol-1
C:2.3KJ.mol-1
D:789.3KJ.mol-1
答案: 2.3KJ.mol-1
下列哪一反应(或过程)的熵值是减小的( )
A:反应C(s) + 1/2 O2(g) = CO(g)
B:NaCl晶体从溶液中析出
C:CuSO4·5H2O晶体溶于水
D:固态I2的升华
答案: NaCl晶体从溶液中析出
反应MgCl2(s) = Mg(s) + Cl2(g),
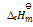
>0,标准状态下,此反应:()
A:低温自发
B:任何温度均不可能自发
C:高温自发
D:任何温度均自发
答案: 高温自发
在298.15K和标准态时,下列反应均为非自发反应,其中在高温下仍为非自发反应的是( )
A:
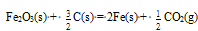
B:
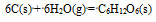
C:
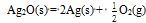
D:
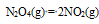
答案:
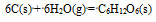
根据数据Df

(NO,g) = 86.5KJ.mol-1 , ΔfGθm(NO2,g) = 51.3KJ.mol-1, 反应 (1) N2(g) + O2(g) = 2NO(g) ; (2) 2NO(g) + O2(g) = 2NO2(g) , 在标准状态下进行的情况说明正确的是( )
A:(1)和(2)都不能自发
B:(1)和(2)都能自发
C:(1)能自发(2)不能
D:(2)能自发 (1)不能
答案: (2)能自发 (1)不能
根据盖斯定律判断下列等式哪一项是正确的?( )
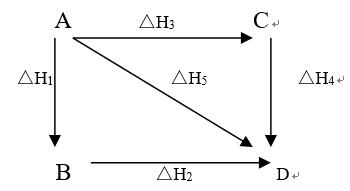
A:(△H1+ △H2 )-(△H3 +△H4)= △H5
B:△H1+ △H2+△H3 =△H4
C:△H1+△H2+△H3+△H4 =△H5
D:△H1+ △H2 = △H3 +△H4
答案: △H1+ △H2 = △H3 +△H4
已知下列热化学方程式
(1)C(g) + O2(g) = CO2(g)
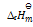
= –394KJ·mol-1
(2)H2 (g) + 1/2O2(g) = H2O(l)
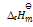
= –286KJ·mol-1
(3)C2H6(g) + 7/2O2(g) = 2CO2(g) +3H2O(l)
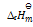
= –286KJ·mol-1
由此可得C2H6 (g)的
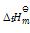
(298.15K)等于()
A:无法计算
B:–1360KJ·mol-1
C:
+86 KJ·mol-1
D: –86KJ·mol-1
答案: –1360KJ·mol-1
天然气的主要成分是CH4, 已知CH4(g),CO2(g)及H2O(l)的
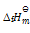
(KJ·mol-1)分别为 –75,–394以及–286,那1m3(273K,101kPa) CH4完全燃烧时,应放热:()
A:无法计算
B:3.96×104KJ
C:2.7×104KJ
D:891KJ·mol-1
答案: 3.96×104KJ
小苏打(NaHCO3)按下式分解生成纯碱(Na2CO3)
2NaHCO3(s) = Na2CO3(s) + CO2(g) + H2O(g)
已知在273K 时,
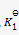
=0.23,在323K时
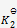
=3.9×10-4,那么上述反应( )
A:

B:
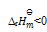
C:
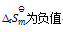
D:
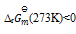
答案:
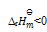
下列说法正确的是:( )
A:指定温度下,元素稳定单质的
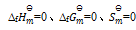
B:化合物的标准熵是由稳定单质在标准状态下,生成该化合物的熵变
C:能燃烧的物质含有热量,反之则不含有热量
D:应用盖斯定律,不仅可以计算化学反应的
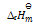
,还可计算
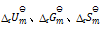
答案: 应用盖斯定律,不仅可以计算化学反应的
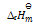
,还可计算
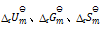
若某反应的
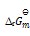
= 10KJmol-1,由此可推断该反应( )
A:在非标准状态下一定不能自发进行
B:在标准状态下不能自发进行
C:不能自发进行
D:
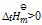
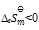
答案: 在标准状态下不能自发进行
同温同压条件下,按熵值递增次序排列正确的( )
A:H2O(l) H2O(g) H2O(s)
B:O3(g) O2(g) O(g)
C:Na(s) NaCl(s) CaCl2(s)
D:Cl2(l) Br2 (l) I2(s)
答案: Na(s) NaCl(s) CaCl2(s)
()反应NO (g) + CO (g)
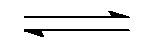
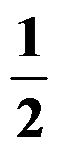
N2 (g) + CO2 (g)
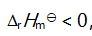
,欲使有害气体 NOCO 尽可能转化为 N2和 CO2
应采取的条件是( )。
A:低温高压
B:低温低压
C:高温高压
D:高温低压
答案: 低温高压
()升高温度后,某化学反应平衡常数增大,则此反应( )。
A:
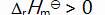
B:
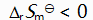
C:
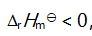
D:
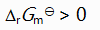
答案:
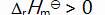
()反应 C (s) + CO2 (g)

2 CO (g) 的平衡常数
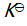
等于( )。
A:
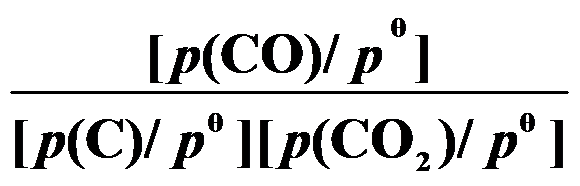
B:
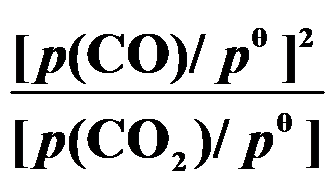
C:
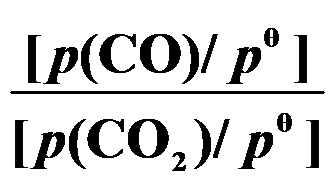
D:
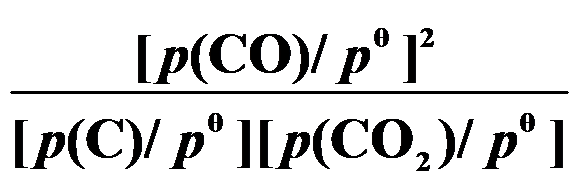
答案:
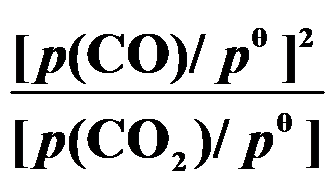
()某反应在 T1时达到平衡,测得平衡常数
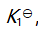
,温度下降到 T2 达到平衡,测得平衡常数
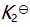
,且
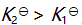
,此反应的
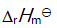
应为( )。
A:大于0
B:由
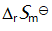
决定
C:0
D:小于0
答案: 小于0
()在密闭溶器中,ABC三种理想气体建立化学平衡,它们的反应是:A + B

C,在相同的温度下若体积缩小2/3,则平衡常数为原来的( )。
A:2倍
B:不变
C:3倍
D:9倍
答案: 不变
下列说法正确的是( )
A:化学反应商Q和标准平衡常数的单位均为1
B:反应 CO2 + H2 = CO + H2O在673K和873K时
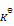
分别为0.080和0.41,这个反应是放热反应
C:可逆反应达到平衡时,正反应速率等于逆反应速率
D:催化剂不影响化学平衡
答案: 反应 CO2 + H2 = CO + H2O在673K和873K时
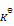
分别为0.080和0.41,这个反应是放热反应
下列说法错误的是( )
A:
一个反应达平衡之后,测定各物质浓度得平衡常数
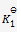
,加入一些产物,在相同温度下,重新达到平衡之后,再测定各物质的浓度,得到
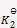
,这两次结果应该相同
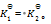
B:
一定温度下,1,2两反应的标准摩尔吉布斯自由能间的关系为
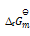
1=2
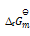
2
则两反应标准平衡常数间的关系为
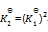
C:对于反应前后,气体分子数不改变的反应,改变压力对平衡无影响
D:
浓度或压力的改变使化学平衡移动的原因是改变了反应商值;而温度的改变使化学平衡移动的原因是引起
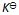
的变化
答案:
一定温度下,1,2两反应的标准摩尔吉布斯自由能间的关系为
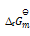
1=2
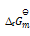
2
则两反应标准平衡常数间的关系为
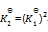
某反应 A(g) + B(g) = G(g) + H(g) 的

= 10-12,这意味着:( )
A:该反应是可逆反应,且两个方向进行的机会相等
B:正反应能进行但进行的程度不大
C:反应物A和B的初始浓度太低
D:正反应不可能进行,生成物不存在
答案: 正反应能进行但进行的程度不大
反应
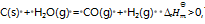
下列叙述正确的是( )
A:
升高温度使其
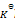
减少
B:加入催化剂可以提高反应物的转化率
C:此反应为吸热反应,升高温度则正反应速率增加,逆反应速率减少,所以平衡右移
D:增大压力不利于H2O(g)的转化
答案: 增大压力不利于H2O(g)的转化
反应
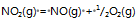
的
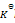
=a则反应:2NO2(g)=2NO(g)+O2(g)的
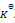
应为( )
A:1/a
B:
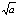
C:a2
D:a
答案: a2
已知下列前三个反应的平衡常数分别为
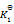
,
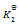
和
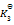
1) N2(g) + O2(g) = 2NO(g)
(2) H2(g) + 1/2 O2(g) = H2O(g)
(3) 2NH3(g) + 5/2 O2(g) = 2 NO(g) + 3 H2O(g)

(4) N2(g) + 3 H2(g) = 2NH3(g)
则第四个反应的
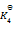
为( )
A:
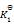
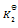
/
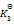
B:
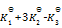
C:
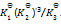
D:
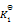
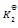
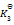
答案:
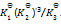
在5000C时,在1升密闭容器中,以1mol N2,3mol H2和2mol NH3。开始进行反应(此时反应的
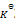
= 0.08)那么平衡时:( )
A:总的物质的量是6
B: N2H2和NH3.物质的量之比是1:3:2
C:N2的物质的量为1
D:N2和H2物质的量之比是1:3
答案: N2和H2物质的量之比是1:3
反应 PCl5(g) = PCl3(g) + Cl2(g),平衡时总压力为
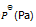
,离解率为50%。则此时的
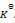
为( )
A:1/4
B:1/2
C:1
D:1/3
答案: 1/3
气体反应 A(g) + B(g) = C(g), 在封闭容器中建立了化学平衡,如果温度不变,但体积缩小了2/3,则平衡常数
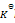
为原来的( )
A:9倍
B:2倍
C:不变
D:3倍
答案: 不变
改变下列哪种情况,对任何已达到平衡的反应可使其产物增加( )
A:增加反应物浓度
B:升温
C:减低温度
D:加压
答案: 增加反应物浓度
反应2A(g) + B(g) = 2C(g) 的
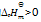
下列叙述正确的是( )
A:正反应为吸热反应,升高温度正反应速率增加,逆反应速率减少,平衡右移
B:
根据
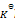
的表达式, 随着反应的进行,C浓度不断增加,AB浓度不断减少,故
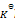
不断增大
C:增加压力,使c(A)及c(B)均增加,平衡不移动。
D:加入催化剂只能缩短达到平衡的时间,不改变平衡常数。
答案: 加入催化剂只能缩短达到平衡的时间,不改变平衡常数。
合成硝酸时,吸收塔内的反应为:3NO2(g) + H2O(l) = 2HNO3(aq) + NO(g)
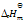
= -2001 KJ mol-1,为了增加HNO3的平衡产率,必须( )
A:减压并降温
B:减压并升温
C:加压并升温
D:加压并降温
答案: 加压并降温
乳酸的化学式用HLac表示。已知HLac + H2O = H3O+ + Lac–
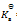
=1.4×10-4
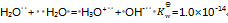
那么反应 Lac– + H2O = HLac + OH–的
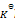
值为()

A:
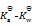
B:
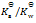
C:
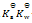
D:
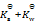
答案:
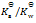
下列叙述中不正确的是()
A:
反应热效应的数值(
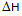
)愈大,温度对其平衡常数的影响就愈大
B:
由于120°C时反应 Ag2CO3 (s) ) ® AgO (s) + CO2 (g) 的
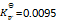
,此时若空气中CO2的体积百分数为1%,则Ag2CO3不会分解
C:若反应方程式两边物质的总物质的量不等,只要改变体系的总压,平衡就一定发生移动
D:某气体反应方程式中的系数愈大,则其分压的变化对平衡移动的影响就愈大
答案: 若反应方程式两边物质的总物质的量不等,只要改变体系的总压,平衡就一定发生移动
1000 K时C (石墨) + CO2 (g)

2 CO (g) 反应,平衡时CO2和CO的分压各为10 kPa和61.6 kPa,则此反应的
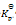
值为( )
A:3.7
B:14.8
C:6.1
D:0.06
答案: 3.7
()某反应,当温度从
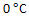
升高到
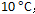
,反应速率变为原来的4倍,若从
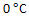
升高到
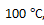
, 则反应速率变为原来的40倍。( )
A:对
B:错
答案: 错
()一反应
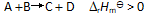
升高温度使平衡向右移动是因为温度升高时,正反应速率
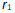
升高,逆反应速率
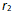
降低造成的。( )
A:错
B:对
答案: 错
()反应系统中加入催化剂后,虽然降低了
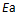
,但
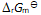
不会因此改变。( )
A:对
B:错
答案: 对
()下列哪种情况系统到达平衡所需时间最少 ( )
A:
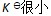
B:
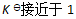
C:无法判断
D:
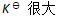
答案: 无法判断
()若反应
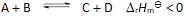
当反应的体系的温度升高时,将会有( )
A:k正 增大 k逆 减小,同时
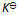
增大
B:
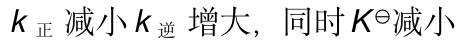
C:
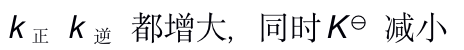
D:
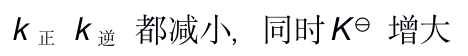
答案:
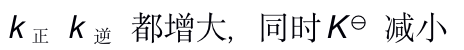
某分解反应,当反应物浓度为0.2 mol·L-1时,反应速度为0.3 mol.L-1.S-1,如果这个反应为二级反应,当反应物浓度为0.6 mol·L-1时,这个反应的反应速度(mol·L-1·S-1)将是( )
A:0.60
B:0.30
C:0.90
D:2.70
答案: 2.70
反应速度随着温度升高而加快的主要理由是()
A:高温下分子的能量增加,使每次碰撞能量增大
B: 活化分子百分数随温度升高而增加
C:活化分子随温度升高而减少
D: 高温下分子碰撞次数增多
答案: 活化分子百分数随温度升高而增加
下列说法正确的是( )
A:提高温度,对活化能较大的反应,反应速率的增加比活化能小的要大
B:有反应Ⅰ、Ⅱ, 298K时反应速率vI > νII, 而318K时 νI II,则 EaI > EaII
C:质量作用定律适用于基元反应也适用于复杂反应
D:零级反应的速率与反应物的浓度有关
答案: 提高温度,对活化能较大的反应,反应速率的增加比活化能小的要大
下列说法正确的是( )
A:正逆反应的活化能数值相等、符号相反
B:对于一个正向为吸热的反应来说,如果升高温度,正向反应速度必然增加,逆向反应速度减少
C:活化分子的平均能量与反应物分子平均能量的差值称为活化能
D:同一化学反应,当条件变更时,活化能减少,反应速度也随之减少
答案: 活化分子的平均能量与反应物分子平均能量的差值称为活化能
下列说法正确的是()
A:零级反应的速度常数k的单位为S-1
B: 当所有反应物的浓度加倍时,反应速度也加倍,那么这个反应必定是一级反应
C: Ea较大的反应,k必定大
D:反应H2(g) + I2(g) = 2HI(g)的速率方程为ν= k C(H2)·C(I2),则该反应为基元反应
答案: 当所有反应物的浓度加倍时,反应速度也加倍,那么这个反应必定是一级反应
反应A + B → C 为一基元反应,该反应的速度常数的单位应当是( )
A:mo·L-1·S-1
B:mol-1·L·S-1
C:S-1
D:L·S-1
答案: mol-1·L·S-1
反应2SO2(g) + O2(g) → 2SO3(g)的反应速率可以表示为
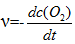
,也可以表示为( )
A:
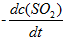
B:
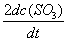
C:
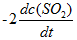
D:
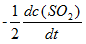
答案:
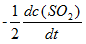
有一化学反应 A + B → D , 三次实验数据如下:
初始(A)∕mol.L-1 初始(B)∕mol.L-1 生成D的初始速率(mol.L-1.S-1)
0.03 0.03 0.3 × 10 -4
0.06 0.06 1.2 × 10 -4
0.06 0.09 2.7 × 10 -4
该反应的速率方程式为()
A:ν = kC(A)C2(B)
B:ν = kC(A)C(B)
C:ν= kC2(B)
D:ν = kC2(A)
答案: ν= kC2(B)
正反应的活化能(Ea正)大于逆反应的活化能(Ea逆),则正反应的标准 摩尔焓变( )
A:
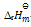
= (Ea正– Ea逆)/2
B:
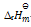
C:无法确定
D:
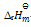
> 0
答案:
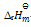
> 0
不会影响反应速率常数k的因素( )
A:反应温度
B:改变反应物浓度
C:催化剂
D:反应活化能
答案: 改变反应物浓度
如图所示,反应A + B → C + D 所涉及的焓相对大小为: 活化配合物 > A + B > C + D ,因此:()
A:该反应不可能有催化剂
B:该反应是放热的
C:逆反应的活化能低于正反应活化能
D:该反应是不可逆的
答案: 该反应是放热的
已知反应2 A(g) + B(g)
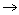
2 C(g) 的
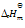
<0 下列哪一项叙述是正确的( )
A:
增加压力,使p(A)p(B)增大,
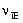
增大,平衡向左移动
B:加入催化剂,同等程度的加快正逆反应的速率,加速达到平衡
C:
升高温度,
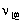
增大,
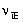
减小,将导致平衡向左移动
D:
由于
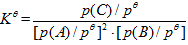
,随着反应的进行,p(C)逐渐增大,p(A),p(B)逐渐减小,平衡常数逐渐增大。
答案: 加入催化剂,同等程度的加快正逆反应的速率,加速达到平衡
对某一化学反应,随着反应的进行将发生下列哪项变化( )
A:反应速率降低
B:平衡常数变小
C:速率常数变小
D:活化能减小
答案: 反应速率降低
300K时鲜牛奶4小时变质,但在277K 时保存48小时,则牛奶的活化能为( )
A:+5.75 KJ·mol-1
B:无法计算
C:+74.5 KJ·mol-1
D:-74.5 KJ·mol-1
答案: +74.5 KJ·mol-1
503K时的反应的活化能为184.1 KJ·mol-1,若加入催化剂后变为104.6 KJ·mol-1,此时正反应速率增加的倍数为( )
A:1.8×108
B:1.0×104
C:1.7×102
D:1.6×106
答案: 1.8×108
下列表述中正确的是( )
A:k值与催化剂的加入无关
B:Ea较大的反应,k必定大
C:k不随温度变化
D:V正通常随时间而减小
答案: k不随温度变化
下列叙述中正确的是( )
A:反应速率与反应物浓度的乘积成正比
B:反应级数等于化学反应式中各反应物计量系数和
C:非基元反应是由若干个基元反应组成的
D:凡速率方程式中各物质浓度的指数等于反应方程式中各反应物的计量系数,此反应为基元反应
答案: 非基元反应是由若干个基元反应组成的
()弱酸浓度越小,a 值越大,故pH越低。( )
A:对
B:错
答案: 错
()在HAc溶液中,加入NaAc越多,HAc离解得越少。( )
A:错
B:对
答案: 错
()下列能做缓冲溶液的是 ( )
A:

B:

C:
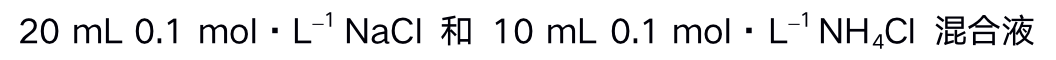
D:

答案:

()在氨水中加入少许NH4Cl后,NH3将 ( )
A:
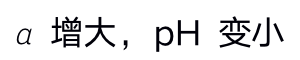
B:

C:

D:

答案:

()一元弱酸HA的
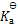
= 5 *10–6,则0.3 mol·L–1溶液的pH值等于 ( )
A:2.91
B:5.30
C:5.82
D:2.39
答案: 2.91
将物质的量浓度相等的NaOH和HAc溶液等体积混合后,混合液中有关离子的物质的量浓度间确定存在的关系是( )
A:C(Na+) + C(H+)>C(Ac–) + C(OH–)
B:C(Na+) >C(Ac–) > C(H+) > C(OH–)
C:C(Na+) >C(Ac–) > C(OH–) > C(H+)
D:C(Na+) >C(OH–)>C(Ac–) + C(H+)
答案: C(Na+) >C(Ac–) > C(OH–) > C(H+)
在25℃时,0.1 mol·L–1某一元弱酸溶液的电离度为0.2%,则此溶液的OH-浓度为( )mol·L–1
A:1×10–10
B:5×10–11
C: 2×10–4
D:5×10–5
答案: 5×10–11
下列说法不正确的是( )
A:用NaOH中和物质的量浓度相同,体积相等的HAc和HCl溶液,所需NaOH的量相等
B:用HCl溶液中和pH相同,体积相等的Ba(OH)2和NaOH溶液,所需HCl的量相等
C:用NaOH中和pH相同,体积相等的HAc和HCl溶液,所需NaOH的量相等
D:用HCl中和物质的量浓度和体积相同的KOH和NH3水溶液所需HCl的量相等
答案: 用NaOH中和pH相同,体积相等的HAc和HCl溶液,所需NaOH的量相等
将0.10 mol.L-1的HAc溶液加水稀释至原体积的2倍时,其H+浓度和PH的变化趋势各为( )
A:为原来的一倍和减小
B:为原来的一半和增大
C:减小和增加
D:增加和减小
答案: 减小和增加
下列叙述中不正确的是( )
A:对于弱酸溶液,浓度越小,电离度越大,氢离子浓度越大
B:对于弱电解质溶液,同离子效应使其电离度减小,盐效应使其电离度增加
C:在多元弱酸的稀溶液中,二元酸根的浓度近似等于其最后一级的离解平衡常数
D:对于弱碱溶液,当加水稀释时,pH值减小
答案: 对于弱酸溶液,浓度越小,电离度越大,氢离子浓度越大
将1升4 mol.L-1氨水与1升2 mol.L-1盐酸溶液混合,混合后OH–离子浓度为( )mol.L-1
A:1.79 × 10-5
B:2
C:8.0 × 10-4
D:1
答案: 1.79 × 10-5
根据平衡移动原理,在0.10 mol.L-1HAc溶液种,下列说法不正确的是( )
A:加入浓HAc,由于增加反应物浓度,平衡向右移动,结果HAc离解度增大
B:用水稀释,离解度增大
C:加入少量HCl溶液,HAc的离解度减少
D:加入少NaOH溶液,平衡向右移动
答案: 加入浓HAc,由于增加反应物浓度,平衡向右移动,结果HAc离解度增大
下列溶液中缓冲能力最大的是( )
A:0.10 mol.L-1 NH3水0.5升与0.10 mol.L-1 NH4Cl水0.05升的混合液
B:0.10 mol.L-1 NH4Cl水0.1升
C:0.20 mol.L-1 NH3水0.5升与0.20 mol.L-1 NH4Cl水0.05升的混合液
D:0.10 mol.L-1 NH3水0.1升
答案: 0.20 mol.L-1 NH3水0.5升与0.20 mol.L-1 NH4Cl水0.05升的混合液
0.025 mol.L-1 HAc溶液与等体积NaAc溶液相混,要使pH维持4.05,混合后酸和盐的浓度比应为( )
A:5 : 1
B:30 : 1
C:50 : 1
D:6 : 1
答案: 5 : 1
用HSO3–[
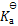
(HSO3-) = 3 .0 × 10-8]和SO32-配制的缓冲溶液的pH范围( )
A:6.5~8.5
B:2.4~4.0
C:10~12
D:2~4
答案: 6.5~8.5
对于下列反应[Al(H2O)6]3+ + H2O → [Al(H2O)5(OH)]2+ + H3O+正确的叙述是( )
A:[Al(H2O)6]3+ 是碱,而H2O是它的共轭酸
B:[Al(H2O)6]3+ 是酸,而[Al(H2O)5(OH)]2+是它的共轭碱
C:[Al(H2O)6]3+ 是碱,而[Al(H2O)5(OH)]2+是它的共轭酸
D:[Al(H2O)6]3+ 是酸,而H2O是它的共轭碱
答案: [Al(H2O)6]3+ 是酸,而[Al(H2O)5(OH)]2+是它的共轭碱
H2O H2Ac+NH4+的共轭碱性强弱顺序是( )
A:NH2– > OH– > Ac–
B:HAc>NH3 >OH–
C:OH– > NH3 >HAc
D:OH– > NH2– >Ac–
答案: OH– > NH3 >HAc
反应Zn2+ + H2O = ZnOH+ + H+ 的

值为2.5 × 10-10,则0.10 mol.L-1的该溶液的pH值是( )
A:6.78
B:4.34
C:3.25
D:5.30
答案: 5.30
均为0.10mol.L-1的三种盐溶液:(1)NH4Cl. (2)NaCN (3)NH4CN 这三种盐溶液pH从大到小的顺序是( )
A: (2) > (3) > (1)
B: (1) > (3) > (2)
C: (1) > (2) > (3)
D:(2) > (1) > (3)
答案: (2) > (3) > (1)
向0.10 mol.L-1H3PO4溶液中滴加NaOH溶液至pH=8.0,溶液中浓度最大的磷酸型体是( )
已知:H3PO4的
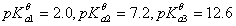
A:PO43-
B:H2PO4-
C:HPO42-
D:H3PO4
答案: HPO42-
在110ml浓度为0.10 mol.L-1的HAc中,加入10ml浓度为0.10mol.L-1的NaOH溶液,则混合溶液的pH值为( )(已知HAc的
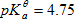
)
A:2.75
B:5.75
C:3.75
D:4.75
答案: 3.75
根据下列质子传递反应, 最强的质子碱是( )
HS– + H2O = S2- + H3O+

CN– + H3O+ = H2O + HCN
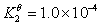
HAC + H2O = H3O+ + AC–
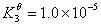
HNO2 + CN– = HCN +NO2–
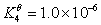
A:NO2–
B:Ac–
C:CN–
D:S2-
答案: S2-
在H2S的饱和水溶液中,下列浓度关系正确的是( )
A:[H2S]≈[S2-]
B:[H2S]≈[H+]+[HS–]
C:[HS–]≈[H+]
D:[S2-]≈2[H+]
答案: [HS–]≈[H+]
0.10 mol.L-1HAc溶液在1升0.10 mol.L-1NaAc水溶液中,HAc的电离度为( )
A:
100
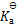
%
B:
10
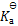
%
C:
100
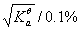
D:
1000
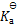
%
答案:
1000
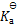
%
0.20 mol.L-1甲酸溶液中3.2%的甲酸已电离,它的电离常数是( )
A:1.25 × 10-6
B:2.1 × 10-8
C:4.8 × 10-5
D:2.1 × 10-4
答案: 2.1 × 10-4
如果乙酸的离解常数是1.75 × 10-5 mol.L-1,则以什么比例混合乙酸和乙酸钠得到pH=6.2的缓冲溶液( )
A:6.3/1.75
B:6.3/175
C:6.3/35
D:6.3/17.5
答案: 6.3/175
担崔滔断毙冕癌盖肉蓖兜笺灌
贿融休朽滤峡晒单城浪瑞献澈