趴搂姥凯糕鹅舒浆噬侥缝策恨
第一章 单元测试
1、
希托夫法测迁移数:用Ag电极电解AgNO3溶液,测出在阳极部AgNO3的浓度增加了x mol,而串联在电路上的Ag库仑计上有y mol Ag析出。则Ag+的迁移数为:( )。
A:
x/y
B:
y/x
C:
(x―y)/x
D:
(y―x)/y
答案:
(y―x)/y
2、
298K时,有相同浓度的NaOH(1)和NaCl(2)水溶液,两溶液中的Na+的迁移数t1与t2之间的关系为:( )。
A:
t1=t2
B:
t1>t2
C:
t1<t2
D:
无法比较
答案:
t1<t2
3、
对于同一电解质的水溶液,当其浓度逐渐增加时,何种性质将随之增加:( )。
A:
在稀溶液范围内的电导率
B:
摩尔电导率
C:
电解质的离子平均活度系数
D:
离子淌度
答案:
在稀溶液范围内的电导率
4、
某一强电解质Mν+ Xν-,其平均活度a±与活度aB之间的关系是:( )。
A:
a±=aB
B:
a±=(aB)2
C:
a±=aBν
D:
a±=(aB)1/ν
答案:
a±=(aB)1/ν
5、
下列电解质溶液中,离子平均活度系数最大的是:( )。
A:
0.01 mol kg–1 NaCl
B:
0.01 mol kg–1 CaCl2
C:
0.01 mol kg–1 LaCl3
D:
0.01 mol kg–1 CuSO4
答案:
0.01 mol kg–1 NaCl
6、
在饱和AgCl溶液中加入NaNO3,AgCl的饱和浓度如何变化:( )。
A:
变大
B:
变小
C:
不变
D:
无法判定
答案:
变大
7、
质量摩尔浓度为m的Na3PO4溶液,平均活度系数为γ±,则电解质的活度为: ( )。
A:
aB=4(m/mө)4(γ±)4
B:
aB=4(m/mө)(γ±)4
C:
aB=27(m/mө)4(γ±)4
D:
aB=27(m/mө)(γ±)4
答案:
aB=27(m/mө)4(γ±)4
8、
浓度为0.1 mol kg–1的MgCl2水溶液,其离子强度为:( )。
A:
0.1 mol kg–1
B:
0.15 mol kg–1
C:
0.2 mol kg–1
D:
0.3 mol kg–1
答案:
0.3 mol kg–1
9、
Al2(SO4)3的化学势μ与Al3+和SO42–的化学势μ+、μ-的关系为:( )。
A:
μ=μ++μ-
B:
μ=3μ++2μ-
C:
μ=2μ++3μ-
D:
μ=μ+ μ-
答案:
μ=2μ++3μ-
10、
下列电解质水溶液中(浓度单位mol kg–1),摩尔电导率最大的是:( )。
A:
HAc:0.001
B:
KCl:0.001
C:
KOH:0.001
D:
HCl:0.001
答案:
HCl:0.001
11、
298K时,Λm(LiI),Λm(H+),Λm(LiCl)的值分别为1.17×10–2、3.50×10–2和1.15×10–2 S m2 mol–1。LiCl中的t+为0.34,假设电解质完全电离,则HI中的t+ 为:( )。
A:
0.18
B:
0.82
C:
0.34
D:
0.66
答案:
0.82
12、
浓度为1.0 mol dm–3的强电解质溶液,它的摩尔电导率数值近似于:( )。
A:
与电导率相等
B:
是电导率的10 3倍
C:
是电导率的10–3倍
D:
是电导率的10 2倍
答案:
是电导率的10–3倍
13、
在10 cm3的1 mol dm–3 KOH溶液中加入10 cm3水,其摩尔电导率将:( )。
A:
增加
B:
减少
C:
不变
D:
不能确定
答案:
增加
14、
欲要比较各种电解质的导电能力的大小,更为合理应为:( )。
A:
电解质的电导率值
B:
电解质的摩尔电导率值
C:
电解质的电导值
D:
电解质的极限摩尔电导率值
答案:
电解质的摩尔电导率值
15、
CaCl2的摩尔电导率与其离子的摩尔电导率的关系是:( )。
A:
Λm∞(CaCl2)=Λ∞m(Ca2+)+Λ∞m(Cl-)
B:
Λm∞(CaCl2)=1/2[Λ∞m(Ca2+)]+Λ∞m(Cl-)
C:
Λm∞(CaCl2)=Λ∞m(Ca2+)+2Λ∞m(Cl-)
D:
Λm∞(CaCl2)=2[Λ∞m(Ca2+)+Λ∞m(Cl-)]
答案:
Λm∞(CaCl2)=Λ∞m(Ca2+)+2Λ∞m(Cl-)
16、
LiCl的无限稀释摩尔电导率115.03×10–4 (S m2 mol–1),在298K时,测得LiCl稀溶液中Li+的迁移数为0.3364,则Cl-的摩尔电导率Λm(Cl-)为:( )。
A:
76.33×10–4 S m2 mol–1
B:
113.03×10–4 S m2 mol–1
C:
38.70×10–4 S m2 mol–1
D:
76.33×102 S m2 mol–1
答案:
76.33×10–4 S m2 mol–1
17、
298K、当HCl溶液的浓度从0.01 mol kg–1增加到0.02 mol kg–1时,其电导率κ和摩尔电导率Λm将: ( )。
A:
κ减小,Λm 增大
B:
κ增加,Λm增加
C:
κ减小,Λm 减小
D:
κ增加,Λm 减小
答案:
κ增加,Λm 减小
18、
浓度均为m的不同价型电解质,设1-3价型电解质的离子强度为I1,2-2价型电解质的离子强度为I2,则I1和I2的关系为:( )。
A:
I1<I2
B:
I1=I2
C:
I1=1.5I2
D:
无法比较
答案:
I1=1.5I2
19、
在一定温度和浓度的水溶液中,带相同电荷数的Li+、Na+、K+、Rb+ 、… 它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于:( )。
A:
离子淌度依次减小
B:
离子的水化作用依次减弱
C:
离子的迁移数依次减小
D:
电场强度的作用依次减弱
答案:
离子的水化作用依次减弱
20、
水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对:( )。
A:
发生电子传导
B:
发生质子传导
C:
离子荷质比大
D:
离子水化半径小
答案:
发生质子传导
21、
溶液是电中性的,正、负离子所带总电量相等,所以正、负离子的迁移数也相等。( )
A:对
B:错
答案: 错
22、
离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。( )
A:对
B:错
答案: 错
23、 离子的摩尔电导率与其价态有关系。( )
A:对
B:错
答案: 对
24、 电解质溶液中各离子迁移数之和为1。( )
A:对
B:错
答案: 对
25、
电解池通过1 F电量时,可以使1 mol物质电解。( )
A:对
B:错
答案: 错
26、
因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。( )
A:对
B:错
答案: 错
27、
无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。( )
A:对
B:错
答案: 错
28、
电解质的无限稀摩尔电导率
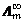 可以由Λm作图外推到c1/2 = 0得到。( )
可以由Λm作图外推到c1/2 = 0得到。( )
A:对
B:错
答案: 错
29、
若a(CaF2) = 0.5,则a(Ca2+) = 0.5,a(F–) = 1。( )
A:对
B:错
答案: 错
30、
对于BaCl2溶液,以下等式成立:
(A) a = γm ; (B) a = a+·a – ; (C) γ± = γ+·γ – 2 ;
(D) m = m+·m– ; (E) m±3 = m+·m–2 ; (F) m± = 4m3 。
( )
A:对
B:错
答案: 错
第二章 单元测试
1、

A:
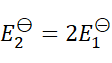
B:
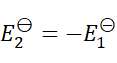
C:
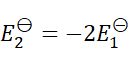
D:
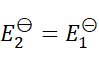
答案:
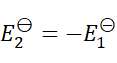
2、
298K时,已知
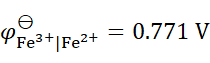 ,
,
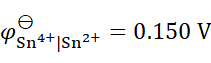 ,则反应2Fe3+ + Sn2+ = 2Fe2+ + Sn4+ 的
,则反应2Fe3+ + Sn2+ = 2Fe2+ + Sn4+ 的
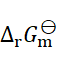 为(设活度因子均为1)( )。
为(设活度因子均为1)( )。
A:–268.7 kJ×mol–1
B: –177.8 kJ×mol–1
C:–119.9 kJ×mol–1
D:119.9kJ×mol–1
答案: –119.9 kJ×mol–1
3、
某电池在298 K和
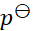 压力下,可逆放电的热效应为QR = –100 J,则该电池反应的
压力下,可逆放电的热效应为QR = –100 J,则该电池反应的
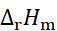 值应为 ( )。
值应为 ( )。
A:100 J
B:–100 J
C:>100 J
D:<–100 J
答案: <–100 J
4、
298K时有如下两个电池:
(1)Cu(s) | Cu+ (a1) || Cu+ (a1), Cu2+ (a2) | Pt
(2)Cu(s) | Cu2+ (a2) || Cu+ (a1), Cu2+ (a2) | Pt
两个电池的电池反应都可写成
Cu (s) + Cu2+ (a2) = 2Cu+ (a1)
则两个电池的
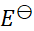 和
和
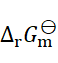 之间的关系为( )。
之间的关系为( )。
A:

B:
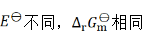
C:
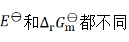
D:
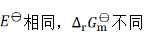
答案:
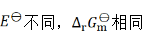
5、
在298 K时,质量摩尔浓度为0.10 mol×kg–1与0.01 mol×kg–1的HCl溶液的液接电势为Ej (1),保持质量摩尔浓度相同而换用KCl溶液,则其液接电势为Ej (2),两者关系为( )。
A:
Ej (1) > Ej (2)
B:
Ej (1) < Ej (2)
C:
Ej (1) = Ej (2)
D:
无法确定
答案:
Ej (1) > Ej (2)
6、
反应为AgCl (s) + I– → AgI (s) + Cl–的电池表达式为( )。
A:
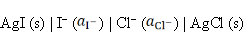
B:
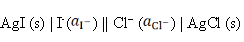
C:
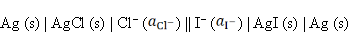
D:
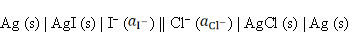
答案:
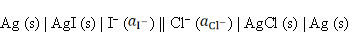
7、
在等温、等压条件下原电池可逆放电,电池反应的焓变与等压可逆热效应Qp的关系为( )。
A:
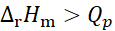
B:
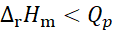
C:
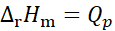
D:
不能确定
答案:
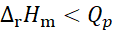
8、
某电池反应为
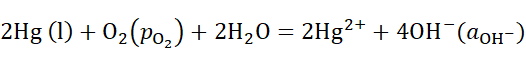 ,当电池反应达平衡时,电池的E值必然( )。
,当电池反应达平衡时,电池的E值必然( )。
A:
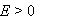
B:
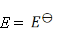
C:
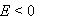
D:
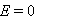
答案:
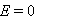
9、
一个充满电的蓄电池以1.7 V的输出电压放电,然后用2.3 V的外电压充电使其恢复原来状态,则在充、放电全过程中,若以电池为系统,功和热的符号为(
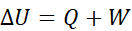 ),那么()。
),那么()。
A:
W = 0, Q = 0
B:
W > 0, Q > 0
C:
W < 0, Q > 0
D:
W > 0, Q < 0
答案:
W > 0, Q < 0
10、
金属与溶液间电势差的大小和符号主要取决于( )。
A:
金属的表面性质
B:
溶液中金属离子的浓度
C:
金属与溶液的接触面积
D:
金属的本性和溶液中原有的金属离子浓度
答案:
金属的本性和溶液中原有的金属离子浓度
11、
用对消法测定由电极Ag (s)| AgNO3 (aq) 和电极Ag (s) | AgCl (s) | KCl (aq)组成的电池的电动势,下列项中不能采用的是( )。
A:
标准电池
B:
电位计
C:
直流检流计
D:
饱和KCl盐桥
答案:
饱和KCl盐桥
12、
有下列两个浓差电池(a1 < a2):
(1)Cu(s) | Cu2+ (a1)|| Cu2+ (a2) | Cu (s)
(2)Pt | Cu2+ (a1), Cu+ (
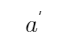 ) ||Cu2+ (a2), Cu+ (
) ||Cu2+ (a2), Cu+ (
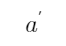 ) | Pt
) | Pt
它们的电池反应与电动势E1和E2之间的关系为( )。
A:
电池反应相同,E1 = E2
B:
电池反应不同,E1 = E2
C:
电池反应相同,E1 = 2E2
D:
电池反应相同,E1 = 1/2E2
答案:
电池反应相同,E1 = 1/2E2
13、
下列电池中,电池反应不可逆的是( )。
A:
Zn | Zn2+ || Cu2+ | Cu
B:Zn | H2SO4 | Cu
C:Pt | H2 (g) | HCl (aq) | AgCl |Ag
D:Pb | PbSO4 |H2SO4 | PbSO4 | PbO2
答案: Zn | H2SO4 | Cu
14、
已知
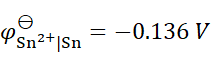 ,
,
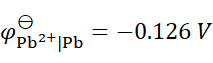 ,将含不同浓度的Sn2+,Pb2+组成下列4种混合溶液,当将Pb (s)分别插入各组溶液时,金属Sn有可能被置换出来的是( )。
,将含不同浓度的Sn2+,Pb2+组成下列4种混合溶液,当将Pb (s)分别插入各组溶液时,金属Sn有可能被置换出来的是( )。
A:
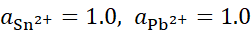
B:
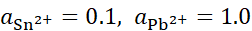
C:
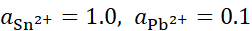
D:
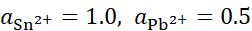
答案:
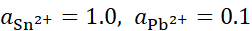
15、
下列电池中,电动势与
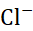 的活度无关的是( )。
的活度无关的是( )。
A:
Zn (s) | ZnCl2 (a) | Cl2 (
 ) | Pt
) | Pt
B:Zn (s) | ZnCl2 (a1) || KCl (a2) | AgCl (s) | Ag (s)
C:Ag (s) | AgCl (s) | KCl (a) | Cl2 (
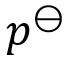 ) | Pt
) | Pt
D:Pt | H2 (
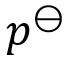 ) | HCl (a) | Cl2 (
) | HCl (a) | Cl2 (
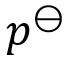 ) | Pt
) | Pt
答案: Ag (s) | AgCl (s) | KCl (a) | Cl2 (
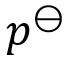 ) | Pt
) | Pt
16、
下列反应AgCl (s) + I– = AgI (s) + Cl–,其可逆电池表达式为:( )。
A:
AgI (s) | Cl– || I– | AgCl (s)
B:
AgI (s) | I– || Cl– | AgCl (s)
C:
Ag (s) | AgCl (s) | Cl– || I– | AgI (s) | Ag (s)
D:Ag (s) | AgI (s) | I– || Cl– | AgCl (s) | Ag (s)
答案: Ag (s) | AgI (s) | I– || Cl– | AgCl (s) | Ag (s)
17、 无论电池中有无电流,只有有液体接界电势存在,就会有液接电势。( )
A:对
B:错
答案: 对
18、
只有种类不同的电解质溶液才会接界的时候产生液接电势。( )
A:对
B:错
答案: 错
19、 玻璃电极能用于测定溶液pH值的电极。( )
A:对
B:错
答案: 对
20、
醌氢醌电极属于离子选择电极。( )
A:对
B:错
答案: 错
21、 玻璃电极是离子选择电极的一种。( )
A:对
B:错
答案: 对
22、
玻璃电极易受溶液中存在氧化剂还有还原剂的影响。( )
A:对
B:错
答案: 错
23、
电池在恒温、恒压和可逆条件下放电,则其与环境间的热交换为0。( )
A:对
B:错
答案: 错
24、
在电极分类中,Pt, H2 | H+属于氧化-还原电极。( )
A:对
B:错
答案: 错
25、 常用醌氢醌电极测定溶液的pH值是因为操作方便,精确度高。( )
A:对
B:错
答案: 对
26、 若用两个电池反串联的方法,可达到完全消除液接电势的目的。( )
A:对
B:错
答案: 对
27、
如果规定标准氢电极的电极电势为1 V,则可逆电极的电极电势
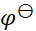 值和电池的电动势
值和电池的电动势
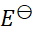 值将发生的变化为( )。
值将发生的变化为( )。
A:

B:

C:
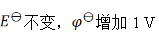
D:
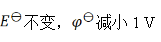
答案:
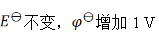
第三章 单元测试
1、
以石墨为阳极,电解 0.01 mol·kg-1 NaCl 溶液,在阳极上首先析出( )。
已知:
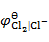 = 1.36 V ,
= 1.36 V ,
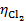 = 0 V,
= 0 V,
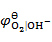 = 0.401V,
= 0.401V,
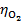 = 0.8 V。
= 0.8 V。
A:Cl2(g)
B:
O2(g)
C:
Cl2与O2混合气体
D:
无气体析出
答案: Cl2(g)
2、
塔菲尔经验式
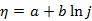 ,用以描述超电势(
,用以描述超电势(
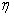 )与电流密度(j)的关系(式中a、b为常数),其适应的范围是( )。
)与电流密度(j)的关系(式中a、b为常数),其适应的范围是( )。
A:
任何电流密度下的气体电极过程
B:任何电流密度下的浓差极化
C:大电流密度下的浓差极化
D:大电流密度下的电化学极化
答案: 大电流密度下的电化学极化
3、
当电流通过原电池或电解池时,电极电势将偏离平衡电极电势而发生极化。当电流密度增大时,通常将发生( )。
A:原电池的正极电势增高
B:原电池的负极电势增高
C:电解池的阳极电势减小
D:无法判断
答案: 原电池的负极电势增高
4、
当发生极化作用时,两电极的电极电势的变化为( )。
A:
j阳变大,j阴变小
B:
j阳变小,j阴变大
C:
两者都变大
D:两者都变小
答案:
j阳变大,j阴变小
5、
用铜电极电解CuCl2的水溶液,不考虑超电势,在阳极上将会发生的反应为(已知
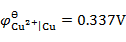 ,
,
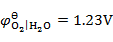 ,
,
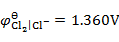 )( )。
)( )。
A:析出氧气
B:析出氢气
C:析出铜
D:铜电极氧化
答案: 铜电极氧化
6、
已知
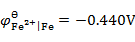 ,
,
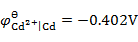 ,将Fe(s)和Cd(s)的粉末投入含Fe2+(0.10 mol×kg -1)和含Cd2+(0.001 mol×kg -1)的溶液中,Fe(s)和Cd(s)粉将( )。
,将Fe(s)和Cd(s)的粉末投入含Fe2+(0.10 mol×kg -1)和含Cd2+(0.001 mol×kg -1)的溶液中,Fe(s)和Cd(s)粉将( )。
A:
都溶解
B:
Fe(s)不溶,Cd(s)溶解
C:
都不溶解
D:
Fe(s)溶解,Cd(s)不溶
答案:
Fe(s)不溶,Cd(s)溶解
7、
298K时,在0.10 mol×kg -1的HCl溶液中,氢电极的可逆电势约为-0.06V,当用铜电极电解此溶液,氢在Cu电极上的析出电势应( )。
A:大于-0.06V
B:等于-0.06V
C:小于-0.06V
D:无法判定
答案: 小于-0.06V
8、
通电于含有相同浓度的Fe2+,Ca2+,Zn2+和Cu2+的电解质溶液,已知
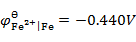 ,
,
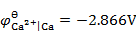
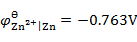 ,
,
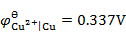 ,设H2因有超电势而不析出,则这些金属在阴极析出的次序为 ( )。
,设H2因有超电势而不析出,则这些金属在阴极析出的次序为 ( )。
A:Ca → Zn → Fe → Cu
B:Ca → Fe→ Zn → Cu
C:Cu → Fe → Zn → Ca
D:Ca → Cu → Zn → Fe
答案: Cu → Fe → Zn → Ca
9、
可充电电池在充电和放电时的电极反应刚好相反,则充电与放电时电极的极性——正极、负极、阴极和阳极——的关系为( )。
A:正极、负极相同,阴极和阳极也相同
B:正极、负极相同,阴极和阳极刚好相反
C:正极、负极改变,阴极和阳极相同
D:正极、负极改变,阴极和阳极刚好相反
答案: 正极、负极相同,阴极和阳极刚好相反
10、
298K时,H2(g)在Zn(s)上的超电势为0.70V,已知
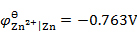 。现在电解一含有Zn2+(
。现在电解一含有Zn2+(
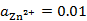 )的溶液,为了使H2(g)不与Zn(s)同时析出,溶液的pH应至少控制在( )。
)的溶液,为了使H2(g)不与Zn(s)同时析出,溶液的pH应至少控制在( )。
A:pH>2.06
B:pH>2.72
C:pH>7.10
D:pH>8.02
答案: pH>2.06
11、
Tafel公式
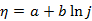 的适用范围是( )。
的适用范围是( )。
A:
仅限于氢超电势
B:
仅限于j»0,电极电势稍有偏差的情况
C:
仅限于阴极超电势,可以是析出氢,也可以是其他
D:
可以是阴极超电势,也可以是阳极超电势
答案:
可以是阴极超电势,也可以是阳极超电势
12、
电解金属盐的水溶液时,在阴极上( )。
A:还原电势愈正的粒子愈容易析出
B:还原电势与其超电势之代数和愈正的粒子愈容易析出
C:还原电势愈负的粒子愈容易析出
D:还原电势与其超电势之和愈负的粒子愈容易析出
答案: 还原电势与其超电势之代数和愈正的粒子愈容易析出
13、
下列示意图描述了原电池和电解池中电极的极化规律,其中表示原电池阳极的是( )。
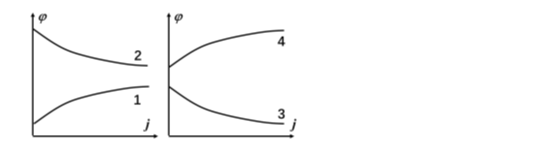
A:曲线1
B:曲线2
C:曲线3
D:曲线4
答案: 曲线1
14、
在电解AgNO3时,电极发生极化时( )。
A:阴极的还原电极电势增大
B:
阴极附近 Ag+ 浓度增加
C:电解池电阻减小
D:两极之间电势差增大
答案: 两极之间电势差增大
15、
以下现象与电化学腐蚀无关的是( )。
A:黄铜(铜锌合金)制作的铜锣不易产生铜绿
B:生铁比软铁芯(几乎是纯铁)容易生锈
C:铁制器件附有铜制配件,在接触处易生铁锈
D:银制奖牌久置后表面变暗
答案: 银制奖牌久置后表面变暗
16、
下列关于化学电源的叙述错误的是( )。
A:普通锌锰干电池中碳棒为正极
B:
铅蓄电池中覆盖着PbO2的电极板是负极板
C:氢氧燃料电池的正极是通入氧气的那一极
D:碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高
答案: 碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高
17、
下列对铁表面防护方法中,属于“电化”保护的是( )。
A:表面喷漆
B:电镀
C:Fe件上嵌Zn块
D:加缓蚀剂
答案: Fe件上嵌Zn块
18、
溴-锌蓄电池的基本结构是用碳棒作两极,用ZnBr2溶液作电解液,现有四个电极反应:①Zn – 2e–= Zn2+ ②Zn2+ + 2e– = Zn ③Br2 + 2e– = 2Br- ④2Br-–2e– = Br2,充电时的阳极和放电时的负极反应分别依次为( )。
A:
④①
B:
②③
C:③①
D:②④
答案:
④①
19、
用铂电解氯化铜溶液时,阳极放出氧气。( )
A:对
B:错
答案: 错
20、 电化学中,用电流密度来表示电极反应速率。( )
A:对
B:错
答案: 对
21、
用铂电极电解硫酸铜溶液时,溶液pH值升高。( )
A:对
B:错
答案: 错
22、
极化和超电势是同一个概念。( )
A:对
B:错
答案: 错
23、 电解、电镀、化学电源和电化学腐蚀都是热力学不可逆过程。( )
A:对
B:错
答案: 对
24、 阳离子在阴极上析出时,阴极电势比其可逆电势更负。( )
A:对
B:错
答案: 对
25、
对原电池,负极极化曲线即阴极极化曲线。( )
A:对
B:错
答案: 错
26、
分解电压对电解过程是极有意义的数据,当电极、电解液、温度等一定时,分解电压很稳定,测量时重复性好。( )
A:对
B:错
答案: 错
27、
超电势大小是衡量极化程度的量度。( )
A:对
B:错
答案: 对
上方为免费预览版答案,如需购买完整答案,请点击下方红字
为了方便下次阅读,建议在浏览器添加书签收藏本网页
添加书签方法:
1.电脑按键盘的Ctrl键+D键即可收藏本网页
2.手机浏览器可以添加书签收藏本网页


如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
我们的公众号
打开手机微信,扫一扫下方二维码,关注微信公众号:萌面人APP
本公众号可查看各种网课答案,还可免费查看大学教材答案
点击这里,可查看公众号功能介绍

萌面人优惠券:一键领取淘宝,天猫,京东,拼多多无门槛优惠券,让您购物省省省,点击这里,了解详情
团捅敲肩篓秆巾眠酗哆勉袱怪