较溉输灸固杠链贺瞧怯逼铜艰
嘘七旦晃赤俊蒜零寿晒动梳赌
欲使被半透膜隔开的两种溶液间不发生渗透,应使两溶液( )A:质量浓度相同 B:物质的量浓度相同 C:渗透浓度相同 D:质量摩尔浓度相同 答案: 渗透浓度相同
答案:点击这里查看答案
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
在使用物质的量单位(mol)时,要注意基本单元的表示。若n(H2O)=1.0 mol,则n(1/2H2O) 的数值为( )
A: 0.5 mol
B: 2.0 mol
C: 1.0 mol
D: 3.0 mol
答案: 2.0 mol
对于非电解质稀溶液,其渗透浓度在数值上等于其质量摩尔浓度。
A:对
B:错
答案: 对
临床上将
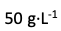
葡萄糖溶液与
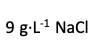
溶液作为等渗溶液使用。如将此两溶液以任意比例混合,则所得混合液也必然是等渗溶液。
A:对
B:错
答案: 对
渗透浓度为

的NaCl溶液和

的葡萄糖溶液,它们的渗透压相等,则它们的物质的量浓度也相等。
A:错
B:对
答案: 错
由于0 ℃的冰与0 ℃的NaCl溶液温度相同,所以该两相可以共存。
A:错
B:对
答案: 错
难挥发非电解质稀溶液的沸点升高凝固点降低均由溶液的蒸气压下降引起。
A:错
B:对
答案: 对
无论溶质是电解质还是非电解质,凝固点降低值较小的溶液的渗透压一定低于凝固点降低值较大的溶液。
A:对
B:错
答案: 对
由于苯比水易挥发,故在相同温度下,苯的蒸气压比水大。
A:对
B:错
答案: 对
将相同质量的葡萄糖和甘油分别溶于1 L水中,则两溶液的△p1=△p2,△Tb1=△Tb2,p1=p2(T一定)。
A:对
B:错
答案: 错
纯溶剂通过半透膜向溶液渗透的压力称为渗透压。
A:错
B:对
答案: 错
渗透浓度均为

的NaCl溶液和葡萄糖溶液,NaCl溶液的渗透压大。
A:错
B:对
答案: 错
渗透压较高的溶液其物质的量浓度一定较大。
A:错
B:对
答案: 错
下列方法最适用于测定蛋白质相对分子质量的是( )
A:凝固点降低法
B:沸点升高法
C:渗透压法
D:蒸气压下降法
答案: 渗透压法
已知水的

,测得某人血清的凝固点为-0.56 ℃,则该血清的渗透浓度为( )
A:408 mmol·L-1
B:506 mmol·L-1
C:560 mmol·L-1
D:301 mmol·L-1
答案: 301 mmol·L-1
已知苯的凝固点为5.35 ℃,
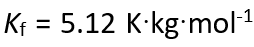
。若将0.320 g萘溶于40 g苯,所得溶液的凝固点为5.03℃,则萘的相对分子质量为( )
A:128
B:256
C:60
D:90
答案: 128
已知钠的相对原子质量为23,Cl的相对原子质量为35.5。某患者需补充Na+ 50.0 mmol,应输入生理盐水( )
A:310mL
B:325mL
C:123 mL
D:1280mL
答案: 325mL
溶解0.50 g某非电解质于50 g水中,测得该溶液的凝固点为-0.31℃。已知水的
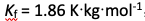
,则该非电解质的相对分子质量为( )
A:56
B:30
C:36
D:60
答案: 60
溶解1.0 g非电解质及0.488 g NaCl(Mr =58.5)于200 g水中,测得该溶液的凝固点为-0.31℃。已知水的
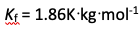
,则该非电解质的相对分子质量为( )
A:56
B:30
C:36
D:60
答案: 60
非电解质稀溶液的蒸气压下降沸点升高凝固点降低的数值取决于( )
A:溶液的体积
B:溶液的质量浓度
C:溶液的温度
D:溶液的质量摩尔浓度
答案: 溶液的质量摩尔浓度
在4份等量的水中,分别加入相同质量的葡萄糖
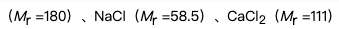
蔗糖(Mr =342),则凝固点降低最多的溶液是 ( )
A:葡萄糖溶液
B:
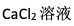
C:蔗糖溶液
D:NaCl溶液
答案: NaCl溶液
欲使被半透膜隔开的两种溶液间不发生渗透,应使两溶液( )
A:质量浓度相同
B:物质的量浓度相同
C:渗透浓度相同
D:质量摩尔浓度相同
答案: 渗透浓度相同
相同温度下,下列四个溶液中渗透压最大的是( )
A:
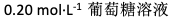
B:

C:
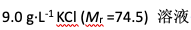
D:
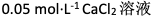
答案:

会使红细胞发生皱缩的溶液是( )
A:
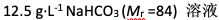
B:

C:

D:

答案:

会使红细胞发生溶血的溶液是( )
A:
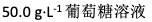
B:生理盐水和10倍体积水的混合液
C:

D:
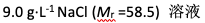
答案: 生理盐水和10倍体积水的混合液
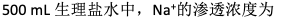
( )
A:

B:

C:

D:

答案:

一种酸的强度与它在水溶液中的哪个物理量有关( )
A:活度
B:解离常数
C:解离度
D:浓度
答案: 解离常数
对于强电解质溶液,下列说法错误的是 ( )
A:浓度越大,活度系数越大
B:活度系数越小,表观电离度也越小
C:浓度极稀时,活度系数接近于1
D:浓度越大,活度系数越小
答案: 浓度越大,活度系数越大
下列各性质中不属于溶胶动力学性质的是( )
A:沉降平衡
B:布朗运动
C:电泳
D:扩散
答案: 电泳
过量的KI与AgNO3混合制备溶胶,则胶粒是指( )
A: (AgI)m·nI–
B: [(AgI)m·nI–·(n–x)K+]x–
C:[(AgI)m·nI–·(n–x)K+]x–·xK+
D: (AgI)m
答案: [(AgI)m·nI–·(n–x)K+]x–
关于表面张力和表面自由能,下列说法正确的是( )
A:物理意义和量纲相同,单位不同
B:物理意义相同,量纲和单位不同
C:物理意义不同,量纲和单位相同
D:物理意义和单位不同,量纲相同
答案: 物理意义和单位不同,量纲相同
通常称为表面活性剂的物质是指将其加入液体中后( )
A:能显著降低液体的表面张力
B:能降低液体的表面张力
C:能增大液体的表面张力
D:能显著增大液体的表面张力
答案: 能显著降低液体的表面张力
毛笔蘸上水,笔毛就会黏在一起,这是因为( )
A:水具有黏度
B:笔毛被润湿
C:水是表面活性物质
D:笔毛上的水在空气中有自动收缩减小表面的趋势
答案: 笔毛上的水在空气中有自动收缩减小表面的趋势
溶胶的基本特性之一是( )
A:热力学上和动力学上皆属于不稳定体系
B:热力学上不稳定而动力学上稳定体系
C:热力学上稳定而动力学上不稳定体系
D:热力学上和动力学上皆属于稳定体系
答案: 热力学上不稳定而动力学上稳定体系
溶胶是均相系统,在热力学上是稳定的。
A:对
B:错
答案: 错
有无Tyndall效应是溶胶和分子分散系统的主要区别之一。
A:错
B:对
答案: 对
在外加直流电场中,碘化银正溶胶向负极移动,而其扩散层向正极移动。
A:错
B:对
答案: 对
由于大分子溶液时真溶液,是均相的热力学稳定系统,所以无Tyndall效应。
A:错
B:对
答案: 错
物质的表面张力与表面积的大小有关。
A:错
B:对
答案: 错
溶胶中胶粒的布朗运动就是本身热运动的反映。
A:对
B:错
答案: 错
正负吸附现象是矛盾的对立统一,负吸附就是解吸。 ( )
A:对
B:错
答案: 错
高分子溶液的渗透压力符合范特霍夫公式。( )
A:错
B:对
答案: 错
下列物理量中哪些是强度性质( )
A:Q
B:Um
C:H
D: W
答案: Um
A:Cl2(l)
B:Fe(s)
C:Ne(g)
D:C(石墨)
答案: Cl2(l)
A:-317.5
B:317.5
C:-519.6
D:519.6
答案: -519.6
A:Ag+(aq) +Br–(aq)=AgBr(s)
B:Ag(s) +1/2 Br2(l)= AgBr(s)
C:2Ag(s) + Br2(l)=2AgBr(s)
D:Ag(s) +1/2 Br2(g)= AgBr(s)
答案: Ag(s) +1/2 Br2(l)= AgBr(s)
对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定值的是( )
A:W(Q=0)
B:Q+W
C:Q
D:Q(W=0)
答案: Q
某系统在失去15 kJ热给环境后,体系的内能增加了5 kJ,则体系对环境所作的功是( )
A:10 kJ
B:20 kJ
C:-10 kJ
D:-20 kJ
答案: 20 kJ
对于任一过程,下列叙述正确的是( )
A:系统所作的功与反应途径无关
B:其余选项均不正确
C:系统的内能变化与反应途径无关
D:系统所吸收的热量与反应途径无关
答案: 系统的内能变化与反应途径无关
298 K时,H2(g) + 1/2O2(g) = H2O(l) 的Qp与QV之差(kJ·mol-1)是( )
A:3.7
B:-3.7
C:-1.2
D:1.2
答案: -3.7
25℃时H2(g)的标准摩尔燃烧焓在量值上等于25℃是H2O(g)的标准摩尔生成焓。
A:对
B:错
答案: 对
系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。
A:对
B:错
答案: 对
孤立体系的熵是守恒的。
A:对
B:错
答案: 错
系统在某一过程中向环境放热,则体系的内能减少。
A:错
B:对
答案: 错
从同一始态经不同的过程到达同一终态,通常Q和W的改变量值不同,但Q+W的改变量值是相同的。
A:错
B:对
答案: 对
A:错
B:对
答案: 对
A:对
B:错
答案: 错
一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
A:对
B:错
答案: 错
平衡常数与反应物初始浓度无关,但转化率随初始浓度而改变。
A:错
B:对
答案: 对
一定温度下,反应达平衡状态时,体系中各组分的浓度相等。
A:错
B:对
答案: 错
在一定条件下所有化学反应都可达到化学平衡。
A:对
B:错
答案: 错
平衡常数是化学反应到达平衡状态时的常数,因此不论正反应还是逆反应,其平衡常数都是相等的。
A:对
B:错
答案: 错
改变下列哪一个因素,能使平衡体系中生成物的浓度增加 ( )
A:加入催化剂
B:增加反应物的初始浓度
C:升高温度
D:增加压力
答案: 增加反应物的初始浓度
在生产中,化学平衡原理主要用于 ( )
A:恒温下的化学反应
B:处于平衡态的反应
C:反应速率不很慢的反应
D:一切化学反应
答案: 处于平衡态的反应
下列关于平衡移动的说法中,正确的是( )
A:在平衡移动中,平衡常数 总是保持不变
B:平衡移动是指反应从不平衡到平衡的过程
C:对反应前后分子数不等的气体反应,达到平衡时,保持总体积不变,充入惰性气体增加系统总压时,原平衡不会移动
D:加压总是使反应从分子数多的一方向分子数少的一方移动
答案: 对反应前后分子数不等的气体反应,达到平衡时,保持总体积不变,充入惰性气体增加系统总压时,原平衡不会移动
化学反应的等温方程式是( )
A:
B:
C:
D:
答案:
对某气体反应,其实验平衡常数Kp与标准平衡常数的关系为( )
A:
B:
C:
D:
答案:
在A2B难溶电解质的饱和溶液中,若[A] = x,[B] = y,则 = 4×2 y。( )
A:错
B:对
答案: 错
已知K (AgBrO3)=5.510-5,K (Ag2SO4)=1.410-5,则AgBrO3的溶解度比Ag2SO4的小。( )
A:错
B:对
答案: 错
298K时,Mg(OH)2的 为5.61´10-12,则其在水中溶解度为 ( )
A:1.12´10-6 mol•L-1
B:1.12´10-4 mol•L-1
C:1.77´10-4 mol · L-1
D:2.36´10-6 mol•L-1
答案: 1.12´10-4 mol•L-1
某化学反应的速率常数单位为dm3·mol-1·min-1,则该反应的反应级数为( )
A:0
B:3
C:2
D:1
答案: 2
某一反应在有限的时间内可反应完全,所需时间为c0/k,该反应的级数为( )
A:二级
B: 一级
C:三级
D:零级
答案: 零级
反应CO(g) + 2H2(g)→CH3OH(g)在等温等压下进行,当加入某种催化剂,该反应速率明显加快。不存在催化剂时,反应的平衡常数为K,活化能为Ea,存在催化剂时分别为K’和Ea’,则( )
A:K’=K,Ea’>Ea
B:K’<K,Ea’<Ea
C:K’<K,Ea’>Ea
D:K’=K,Ea’<Ea
答案: K’=K,Ea’<Ea
某一级反应,当反应物的浓度降为起始浓度的1%时,需要t1秒,若将反应物的浓度提高一倍,加快反应速率,当反应物浓度降低为起始浓度的1%时,需时为t2秒,则( )
A: t1= t2
B:不能确定二者关系
C:t1>t2
D:t1<t2
答案: t1= t2
对基元反应的以下说法中,不正确的是( )
A:从微观上考虑,基元反应一定是双分子反应
B:基元反应是质量作用定律建立的基础
C:基元反应的活化能才有明确的物理意义
D:只有基元反应才有反应分子数可言
答案: 从微观上考虑,基元反应一定是双分子反应
在同一反应中各物质的变化速率相同。
A:对
B:错
答案: 错
单分子反应一定是基元反应。
A:对
B:错
答案: 对
一个化学反应进行完全所需的时间是半衰期的2倍。
A:错
B:对
答案: 错
对于一般服从阿伦尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
A:对
B:错
答案: 错
温度升高,化学反应的正逆反应速度都会增大,因此反应的平衡常数不随温度变化而变化。
A:对
B:错
答案: 错
反应Ⅰ: A→B,反应Ⅱ:A→D。已知反应Ⅰ的活化能Ea1大于反应Ⅱ的活化能Ea2,以下措施中哪一种不能改变获得B和D的比例( )
A:降低反应温度
B:延长反应时间
C:提高反应温度
D:加入适当的催化剂
答案: 加入适当的催化剂
鲍达撇梅核髓惟袭袍蛔容碴冒
担布溺刮显洞九贤肝凉俏姆讣